

摘 要: 蛋白質吸附、鈣磷離子釋放和表面生物礦化是鈣磷材料誘導異位骨生成的可能材料機制。對比了非表 面微孔羥基磷灰石陶瓷(HA-S)、表面微孔羥基磷灰石陶瓷(HA-R)和表面微孔生物惰性非鈣磷陶瓷(TiO2 陶瓷; 氧化鋁陶瓷;兩者無鈣磷釋放,無表面生物礦化能力)的異位骨誘導能力。研究發現,不同化學成分的陶瓷材料對 蛋白質有選擇性吸附。即使不吸附骨形態發生蛋白-2(rhBMP-2),具有表面微孔的非鈣磷陶瓷也能誘導異位骨 組織生成。結果表明,鈣磷離子釋放和表面生物礦化在磷酸鈣生物材料骨誘導中不起關鍵作用,表面微孔也不一 定通過蛋白質吸附而在異位骨誘導中起作用。
0 引 言
發生在非骨部位的骨再生生物學過程叫骨誘導, 骨誘導較的例子是含有骨形態發生蛋白(BMP) 的種植體在軟組織中的骨組織生成。在不加生長 因子的情況下,具有特殊物理化學特性的磷酸鈣陶瓷 也具有骨誘導能力。其中,材料表面微孔性扮演重 要角色。具有表面微孔的羥基磷灰石陶瓷在肌肉種植 后能夠誘導骨組織生成,但是沒有表面微孔的羥基磷 灰石陶瓷沒有骨誘導能力。
由于磷酸鈣材料對骨形態發生蛋白(BMP)有較 強的吸附能力,具有表面微孔的磷酸鈣陶瓷的骨誘導 作用通常被解釋為微孔擴大了磷酸鈣陶瓷的表面積, 從而可以從體液中吸附更多的蛋白質(包括骨誘導因 子如BMP),而這些被吸附在鈣磷陶瓷表面的蛋白質 骨誘導因子較終誘發了骨組織形成。
另外近年來發現鈣,磷離子對多潛能干細胞的骨 相分化有促進作用。磷酸鈣陶瓷表面微孔在骨誘 導中的作用也被解釋為微孔增加磷酸鈣陶瓷的表面 積,從而有利于鈣磷離子的釋放,釋放的鈣磷離子可能 引發骨誘導。
磷酸鈣材料是典型的生物活性材料。在體液中磷 酸鈣陶瓷材料能在其表面形成類骨磷灰石層。磷 灰石層的形成以及在磷灰石層形成過程中參與進來的蛋白質(包括生長因子)也被認為是磷酸鈣陶瓷骨誘導 的可能原因。
本文考察了不具備表面微孔的羥基磷灰石陶瓷 (HA-S),具備表面微孔的羥基磷灰石陶瓷(HA-R), 具備表面微孔的TiO2 陶瓷和氧化鋁 陶瓷的蛋白吸附 能力,并比較這些陶瓷材料的異位成骨能力。以期論 證蛋白質吸附,鈣磷離子釋放和表面生物礦化在生物 材料異位骨誘導中的可能作用。
1 實 驗
1.1 材料制備
陶瓷材料用雙氧水發泡,并在高溫下燒結制備。 具體來說,羥基磷灰石粉末(Merck,Germany),二氧化 鈦粉末(Fluka,Switzerland)以及三氧化二鋁粉末 (Fluka,Switzerland),分別用稀釋的雙氧水溶液(2% (質量分數))混合均勻,然后在60℃進行發泡和干燥, 制備成陶瓷坯體。HA胚體在1 250℃燒結8h得到 非微孔的的羥基磷灰石陶瓷(HA-S),在1100℃燒結 8h得到微孔的羥基磷灰石陶瓷(HA-R)。TiO2 陶瓷 在1200℃燒結200min,氧化鋁 陶瓷在1300℃燒結 10h。燒結后的陶瓷塊加工成直徑為5mm,長度為 6mm的柱狀樣品,然后分別用丙酮,70%(質量分數) 乙醇和去離子水很聲清洗,干燥后在121 ℃下滅菌 30min。
1.2 材料表征
用X射線衍射儀(X’Pertpro-MPD,the Netherlands) 分析陶瓷材料的化學成分;對材料的表面結構 進行掃描電鏡(HITACHI S4800,Japan)觀察;用BET (TristarⅡ3020,America)方法檢測陶瓷材料的表面 積。
1.3 牛血清蛋白(BSA)和溶菌酶素(lysozyme)的吸 附
將陶瓷樣品(n=3)分別浸泡在3mL含有25× 10-6疊氮化鈉(NaN3)和200μg/mL牛血清蛋白(Fluka, Switzerland)或者20μg/mL 溶菌酶素(Fluka, Switzerland)或者1%(質量分數)胎牛血清(FBS, GibcoTM,Invitrogen corporation,UK)溶液中,并在 37℃水浴中震蕩。7d后,將樣品離心(3 000r/min) 5min,取上清液作蛋白分析。用BCA 蛋白濃度檢測 法(Micro BCATMprotein assay kit,pierce biotechnology, rockford,IL,USA)檢測蛋白質,并用相應蛋白 的標準曲線計算蛋白濃度。
1.4 rhBMP-2的吸附 將4種陶瓷樣品(n=3)浸泡在3mL含有500ng rhBMP-2/mL(Huadong East-China pharmaceutical group investment Co.Ltd,Hangzhou,China)的細胞 培養液中。細胞培養液由DMEM(GibcoTM,Invitrogen corporation,UK),10% 胎牛血清(FBS)(GibcoTM, Invitrogen corporation,UK),100μg/mL盤尼西林和100μg/mL鏈霉素組成。樣品在37 ℃,5% CO2 培養箱中孵化24h后,用磷酸鹽緩沖液(pH 值= 7.4)潤洗3次,并保存在-80℃。12h后每個樣品添 加0.5mL 1% Triton并在4℃冰箱保存。12h后,樣 品在很聲波水浴中處理5min。離心(X3 000r/min) 5min,依照rhBMP-2酶聯免疫反應測定法(rhBMP-2 Elisa,R&D,UK)測定上清液中的rhBMP-2蛋白濃 度。
1.5 動物實驗
6條成熟雄性狗(體重為10~15kg)在本地購買。 麻醉(戊巴比妥鈉(30mg/kg)),消毒(酒精,碘伏)后, 在狗背部用手術刀劃開一個縱向皮膚切口并暴露肌 肉,再鈍性分開肌肉成袋狀,將樣品植入肌肉袋中。
4個單獨的肌肉袋間隔2cm 左右,每個肌肉袋中種植 一個樣品。手術后,肌肉連續注射青霉素3d,防止感 染。12周后,用過量的戊巴比妥鈉處死動物,取出樣 品并固定在4%的福爾馬林溶液中(pH 值=7.4)。 1周后,取出樣品,用PBS沖洗,梯度酒精(70%,85%, 90%,95%,100%×2)脫水,MMA包埋。硬組織切片 機(Leica SP-1600,Germany)切片(10~20μm)。亞 甲基藍和品紅染色后,作定性和定量的組織學觀察。
為了組織形態學分析,切片首先用掃描儀(Dimage Scan Elite 5400II,Japan)掃描,然后用PhotoshopCS5 處理圖片,讀出選中區域、材料、骨頭三者的像素值,根 據公式

計算陶瓷材料大孔中的成骨量和材料在樣品中的 百分比。用光學顯微鏡(Nikon Eclipse E200,Tokyo, Japan)觀察樣品中的組織成分(血管,新生骨組織和成 骨細胞)。
1.6 統計學分析
數據均采用平均值加減標準方差的形式表達。用 量化Turkey對比對數據進行單因素方差統計分析,p <0.05被認定為顯著性差異。
2 結果與討論
2.1 材料表征
材料的XRD圖譜如圖1所示。由圖1可知,HAS 和HA-R在不同溫度燒結(HA-S,1250℃;HA-R, 1100℃),但它們的特征峰與標準羥基磷灰石一致。 TiO2 在2θ=27.6,36.28,41.4,54.5,56.78和69.16°有 明顯的特征衍射峰,與r-TiO2 的XRD 標準峰一致。
氧化鋁 在2θ=25.7,35.3,37.9,43.48,52.68,57.62, 66.62和68.32°處有明顯的特征衍射峰,與α-氧化鋁 的 XRD標準峰一致。
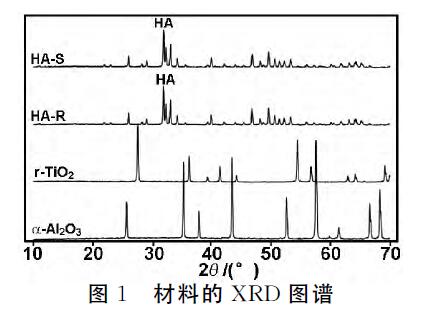
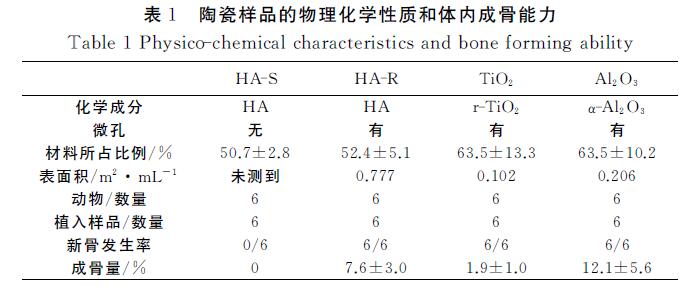
從圖1可知,1 250℃燒結后,HA晶體熔融在一起,導致HA-S形成較光滑的表面(圖2(a)),但是 1 100℃燒結的HA-R表面有豐富的微孔(圖2(b))。 TiO2 表面同樣可以看到豐富的微孔(圖2(c))。在 1 300℃下,很少氧化鋁 晶體(細微顆粒)熔融,顆粒堆 疊在一起形成微孔(圖2(d))。BET 無法檢測HA-S 表面積,HA-R的表面面積為0.777m2/mL,TiO2 的 表面面積為0.102m2/mL,氧化鋁 為0.206m2/mL(表 1)。4種不同的微孔表面結構,材料的表面積不同。
2.2 蛋白吸附
浸泡7d后,不同材料吸附牛血清蛋白(BSA)的 能力各不相同(圖3(a))。HA-S吸附(64±8)μg BSA (占總BSA的(11±1)%),HA-R吸附(485±5)μg BSA(占總BSA的(81±1)%),TiO2 吸附(182±12)μg BSA (占總BSA 的(30±2)%),氧化鋁 吸附(217±16)μg BSA(占總BSA的(36±3)%)。


浸泡7d后,不同材料吸附溶菌酶素(lysozyme) 的能力各不相同(圖3(b))。氧化鋁 能吸附溶菌酶素 較多,HA±S吸附較少。HA±S吸附(1±1)μg(占總 量(2±2)%),HA±R 吸附(6±1)μg(占總量(10± 2)%)。TiO2 吸附(20±1)μg(占總量(33±1)%)。
氧化鋁 吸附(51±1)μg(占總量(85±1)%)。 浸泡7d后,不同材料吸附FBS的能力也不一樣 (圖3(c))。HA-S吸附較少(占總量的6%),HA-R吸 附較多(占總量的34%),TiO2 和氧化鋁 吸附的量大 致一致(分別占總量的12%和12%)。
陶瓷材料化學成分不一樣,蛋白質吸附能力不同。 微孔的HA-R總比無微孔的HA-S吸附更多的蛋白 質,說明對于同一材料,蛋白質吸附與材料微孔和表面 積有關。
2.3 rhBMP-2吸附
HA對rhBMP-2有很強的吸附能力,與微孔和表 面積有關,而TiO2 和氧化鋁 陶瓷對rhBMP-2的吸附 能力很弱(圖4所示)。
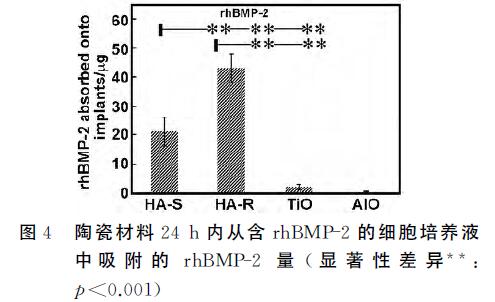
浸泡24h后,HA-S吸收(21.4±4.6)ng rhBMP-2 (占總量的(1.40±0.33)%),HA-R 吸收(42.9±5.3)ng rhBMP-2(占總量的(2.87±0.33)%),TiO2 吸收 (2.2±0.8)ng rhBMP-2(占總量的(0.13±0.06)%), 氧化鋁 吸附(0.4±0.2)ng rhBMP-2(占總量的(0.02± 0.01)%)。這個結果驗證了鈣磷陶瓷對BMP有較強 的親和力,但結果也同時顯示TiO2 和氧化鋁 陶瓷對 rhBMP-2的吸附能力很弱。
2.4 陶瓷材料的成骨能力
肌肉種植12周后,所有HA-R,TiO2,氧化鋁 植入 體都有骨組織生成,但在HA-S中沒有骨生成(表1)。 在HA-S里只發現纖維組織和血管(圖5(a),(e))。除 了纖維組織和血管外,在HA-R的大孔表面還發現有 礦化的骨組織(圖5(b),(f))。與HA-R 類似,TiO2 (圖5(c),(g))和氧化鋁(圖5(d),(h))大孔中有纖維 組織,血管和新生骨組織。
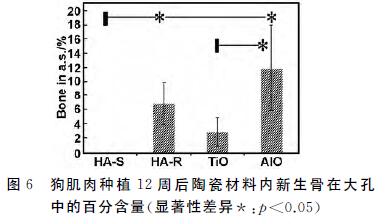
組織形態定量分析總結在圖6和表1,陶瓷種植 體具有不同材料百分比。HA-S中材料占(50.7± 2.8)%,HA-R中材料占(52.4±5.1)%,TiO2 中材料 占(63.5±13.3)%,氧化鋁 中材料占(63.5±10.2)%。 樣品中的成骨量也有差異。HA-R中成骨量為(7.6± 3.0)%,TiO2 中成骨量為(1.9±1.0)%,氧化鋁 中成骨量 為(12.1±5.6)%。由于制備陶瓷的材料百分比不同 (表1),陶瓷有不同的孔隙率,因而無法排除大孔孔隙 率對成骨量的可能影響。但單從新骨發生率的不同, 可以討論材料因素在生物材料骨誘導中的可能功能。
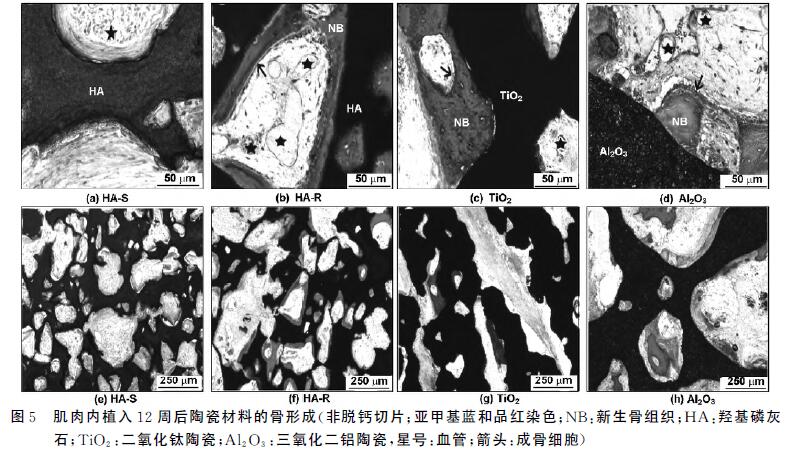
HA-R能夠吸附更多的rhBMP-2,TiO2 和氧化鋁 陶瓷幾乎不吸附rhBMP-2(圖4),而它們都能誘導骨生成(表1,圖5和6)。不同化學組分的陶瓷材料蛋白 質吸附(圖3和4)和成骨能力的比較不能明確蛋白質吸附在生物材料骨誘導中的關鍵作用。 由于鈣磷離子分別對多潛能干細胞的骨相分化有 促進作用,鈣磷離子釋放也通常作為解釋磷酸鈣陶瓷 誘導成骨的原因之一[4]。本文中,骨組織再生除了發 生在微孔結構的HA-R 里,也發生微孔TiO2 和 氧化鋁 陶瓷里。因為TiO2 和氧化鋁 陶瓷根本無法釋 放出鈣磷離子,所以這個結果否定了鈣磷離子在骨誘 導中的關鍵作用。
由于鈣磷離子釋放和重新表面沉積,材料表面形 成類骨磷灰石層,從而使磷酸鈣陶瓷具有生物活性。在類骨磷灰石層形成過程中,體液中的生長因 子參與生物礦化,從而引起生物反應,這也被用來解釋 磷酸鈣陶瓷骨誘導現象。單純的TiO2 和氧化鋁陶瓷是典型的生物惰性材料,不會在模擬體液中形成表面類骨磷灰石層。所以,TiO2和氧化鋁陶瓷誘導成骨 的結果否定了生物礦化在生物材料誘導成骨中的關鍵 作用。 近年來,生物材料的表面物理特性的生物效應研 究取得進展。多潛能干細胞可能根據材料表面微 孔結構而改變它們的形態,而這種細胞形態改變引起 細胞的骨相分化。特異的生物材料表面微孔可能直接誘導骨組織生成。
3 結 論
(1) SEM 和BET的測試結果發現,以雙氧水為 發泡劑,高溫燒結而成的4種陶瓷具有不同的表面結 構和表面積。
(2) 不同化學組分的陶瓷材料蛋白質吸附和成 骨能力的比較不能明確蛋白質吸附在生物材料骨誘導 中的關鍵作用。
(3) TiO2 和氧化鋁陶瓷誘導成骨的結果表明微 孔并不是通過鈣磷離子釋放和表面生物礦化而起作 用,也不一定通過蛋白質吸附引起骨誘導。